Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
Initialising ...
金尾 忠芳*; 小坂 恵*; 吉田 京矢*; 中山 久之*; 玉田 太郎; 黒木 良太; 山田 秀徳; 高田 潤*; 上村 一雄*
Acta Crystallographica Section F, 69(6), p.692 - 694, 2013/06
被引用回数:10 パーセンタイル:58.28(Biochemical Research Methods)鉄硫黄酸化細菌 由来テトラチオン酸加水分解酵素(tetrathionate hydrolase)は無機硫黄化合物の加水分解を触媒する。組換え型酵素
由来テトラチオン酸加水分解酵素(tetrathionate hydrolase)は無機硫黄化合物の加水分解を触媒する。組換え型酵素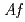 -Tthを大腸菌を用いて封入体として発現し、酸性条件下で活性体に巻き戻した後に、単一に精製した。
-Tthを大腸菌を用いて封入体として発現し、酸性条件下で活性体に巻き戻した後に、単一に精製した。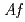 -Tthの結晶は、沈澱剤溶液を33%(
-Tthの結晶は、沈澱剤溶液を33%(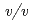 ) PEG 1000、50m
) PEG 1000、50m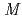 塩化ナトリウム、20m
塩化ナトリウム、20m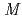 グリシン緩衝液(pH10)としたハンギングドロップ蒸気拡散法により、取得された。結晶は0.2
グリシン緩衝液(pH10)としたハンギングドロップ蒸気拡散法により、取得された。結晶は0.2 0.05
0.05 0.05mmの六角柱状で、X線回折実験の結果、2.15
0.05mmの六角柱状で、X線回折実験の結果、2.15 分解能の回折点が確認され、結晶の空間群は
分解能の回折点が確認され、結晶の空間群は 3
3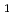 もしくは
もしくは 3
3 、格子定数は
、格子定数は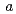 =
=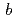 =92.1,
=92.1, 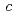 =232.6
=232.6 であった。
であった。
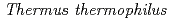 HB8
HB8岡崎 伸生; 安達 基泰; 玉田 太郎; 栗原 和男; 大賀 拓史*; 神谷 信夫*; 倉光 成紀*; 黒木 良太
Acta Crystallographica Section F, 68(1), p.49 - 52, 2012/01
被引用回数:2 パーセンタイル:31.80(Biochemical Research Methods)ADP-ribose pyrophosphatase-I from 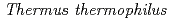 HB8 (
HB8 (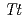 ADPRase-I) prevents the intracellular accumulation of ADP-ribose by hydrolyzing it to AMP and ribose 5'-phosphate. To understand the catalytic mechanism of
ADPRase-I) prevents the intracellular accumulation of ADP-ribose by hydrolyzing it to AMP and ribose 5'-phosphate. To understand the catalytic mechanism of 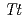 ADPRase-I, it is necessary to investigate the role of glutamates and metal ions as well as the coordination of water molecules located at the active site. A macroseeding method was developed in order to obtain a large
ADPRase-I, it is necessary to investigate the role of glutamates and metal ions as well as the coordination of water molecules located at the active site. A macroseeding method was developed in order to obtain a large 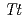 ADPRase-I crystal which was suitable for a neutron diffraction study to provide structural information. Neutron and X-ray diffraction experiments were performed at room temperature using the same crystal. The crystal diffracted to 2.1 and 1.5
ADPRase-I crystal which was suitable for a neutron diffraction study to provide structural information. Neutron and X-ray diffraction experiments were performed at room temperature using the same crystal. The crystal diffracted to 2.1 and 1.5  resolution in the neutron and X-ray diffraction experiments, respectively. The crystal belonged to the primitive space group
resolution in the neutron and X-ray diffraction experiments, respectively. The crystal belonged to the primitive space group  3
3 21, with unit-cell parameters
21, with unit-cell parameters 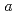 =
= 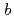 = 50.7,
= 50.7, 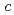 = 119
= 119  .
.
福田 庸太*; 玉田 太郎; 高見 英人*; 鈴木 晋一郎*; 井上 豪*; 野尻 正樹
Acta Crystallographica Section F, 67(6), p.692 - 695, 2011/06
被引用回数:9 パーセンタイル:66.91(Biochemical Research Methods)The soluble region (residues 32-354) of GK0767, a copper-containing nitrite reductase from the thermophilic Gram-positive bacterium 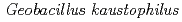 HTA426, has been cloned and overexpressed in
HTA426, has been cloned and overexpressed in 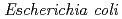 . The purified recombinant protein was crystallized using the hanging-drop vapour-diffusion method. X-ray diffraction data were collected and processed to a maximum resolution of 1.3
. The purified recombinant protein was crystallized using the hanging-drop vapour-diffusion method. X-ray diffraction data were collected and processed to a maximum resolution of 1.3  . The crystals belonged to space group
. The crystals belonged to space group 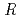 3, with unit-cell parameters
3, with unit-cell parameters 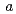 =
= 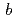 = 115.1,
= 115.1, 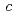 = 87.5
= 87.5  . Preliminary studies and molecular-replacement calculations reveal the presence of one subunit of the homotrimeric structure in the asymmetric unit; this corresponds to a V
. Preliminary studies and molecular-replacement calculations reveal the presence of one subunit of the homotrimeric structure in the asymmetric unit; this corresponds to a V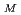 value of 3.14
value of 3.14 
 Da
Da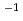 .
.
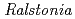 sp. A-471
sp. A-471岡崎 伸生; 有森 貴夫; 中澤 昌美*; 宮武 和孝*; 上田 光宏*; 玉田 太郎
Acta Crystallographica Section F, 67(4), p.494 - 497, 2011/04
被引用回数:3 パーセンタイル:40.34(Biochemical Research Methods)Chitinase from the moderately thermophilic bacterium 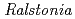 sp. A-471 (Ra-ChiC) is divided into two domains: a chitin-binding domain (residues 36-80) and a catalytic domain (residues 103-252). Although the catalytic domain of Ra-ChiC has homology to goose-type lysozyme, Ra-ChiC does not show lysozyme activity but does show chitinase activity. The catalytic domain with part of an interdomain loop (Ra-ChiC
sp. A-471 (Ra-ChiC) is divided into two domains: a chitin-binding domain (residues 36-80) and a catalytic domain (residues 103-252). Although the catalytic domain of Ra-ChiC has homology to goose-type lysozyme, Ra-ChiC does not show lysozyme activity but does show chitinase activity. The catalytic domain with part of an interdomain loop (Ra-ChiC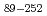 ) was crystallized under several different conditions using polyethylene glycol as a precipitant. The crystals diffracted to 1.85
) was crystallized under several different conditions using polyethylene glycol as a precipitant. The crystals diffracted to 1.85  resolution and belonged to space group
resolution and belonged to space group  6
6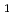 22 or
22 or  6
6 22, with unit-cell parameters
22, with unit-cell parameters 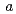 =
= 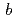 = 100,
= 100, 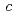 = 243
= 243  . The calculated Matthews coefficient was approximately 3.2, 2.4 or 1.9
. The calculated Matthews coefficient was approximately 3.2, 2.4 or 1.9 
 Da
Da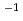 assuming the presence of three, four or five Ra-ChiC
assuming the presence of three, four or five Ra-ChiC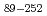 molecules in the asymmetric unit, respectively.
molecules in the asymmetric unit, respectively.
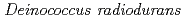
山田 貢; 佐藤 勝也; 鳴海 一成
Acta Crystallographica Section F, 66(12), p.1614 - 1616, 2010/12
被引用回数:1 パーセンタイル:15.59(Biochemical Research Methods)放射線抵抗性細菌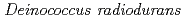 由来のDNA損傷応答タンパク質(DdrA)は、一本鎖DNAの3'末端に結合し、DNA分解酵素からDNA末端を保護することで、DNA修復過程に関与していると考えられている。本研究では、タンパク質構造情報に基づいてDdrAタンパク質の生理的役割を明らかにする目的で、N末端から157残基のアミノ酸配列からなるC末端欠損DdrAタンパク質の結晶を作製し、KEK-PFのBL5ビームラインにてX線結晶回折実験を行った。その結果、最高2.35
由来のDNA損傷応答タンパク質(DdrA)は、一本鎖DNAの3'末端に結合し、DNA分解酵素からDNA末端を保護することで、DNA修復過程に関与していると考えられている。本研究では、タンパク質構造情報に基づいてDdrAタンパク質の生理的役割を明らかにする目的で、N末端から157残基のアミノ酸配列からなるC末端欠損DdrAタンパク質の結晶を作製し、KEK-PFのBL5ビームラインにてX線結晶回折実験を行った。その結果、最高2.35 の分解能の回折像を得ることに成功した。結晶は、擬欠面双晶の非対称ユニット中に14分子を含んでおり、7量体リングが2つ重なった高次構造を有していると考えられた。
の分解能の回折像を得ることに成功した。結晶は、擬欠面双晶の非対称ユニット中に14分子を含んでおり、7量体リングが2つ重なった高次構造を有していると考えられた。
松村 浩由*; 安達 基泰; 杉山 成*; 岡田 詩乃*; 山上 恵*; 玉田 太郎; 日高 興士*; 林 良雄*; 木村 徹*; 木曽 良明*; et al.
Acta Crystallographica Section F, 64(11), p.1003 - 1006, 2008/11
被引用回数:17 パーセンタイル:77.23(Biochemical Research Methods)本論文では、HIV-1プロテアーゼと薬剤候補分子であるKNI-272との複合体の結晶化と予備的中性子結晶構造解析について報告する。この中性子回折研究の目的は、水素原子の構造情報を得ることと活性中心の2つのアミノ酸残基の解離状態を決定することである。結晶化は、2液法を除冷法を組合せて、さらにマクロシーディングを繰り返し、1.4mm のサイズの結晶を得た。中性子回折データは、原子力機構のJRR-3に設置してあるBIX-4を用いて室温にて行った。回折データの分解能2.3
のサイズの結晶を得た。中性子回折データは、原子力機構のJRR-3に設置してあるBIX-4を用いて室温にて行った。回折データの分解能2.3 、空間群はP2(1)2(1)2、格子定数は、a=59.5, b=87.4, c=46.8
、空間群はP2(1)2(1)2、格子定数は、a=59.5, b=87.4, c=46.8 であった。
であった。
田口 千穂; 田浦 太志*; 玉田 太郎; 正山 祥生; 正山 征洋*; 田中 宏幸*; 黒木 良太; 森元 聡*
Acta Crystallographica Section F, 64(3), p.217 - 220, 2008/03
被引用回数:3 パーセンタイル:35.32(Biochemical Research Methods)Polyketide synthase-1 (PKS-1) is a novel type III polyketide synthase that catalyzes biosynthesis of the hexanoyl triacetic acid lactone in 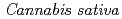 (Mexican strain). PKS-1 was overproduced in
(Mexican strain). PKS-1 was overproduced in 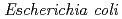 , purified and finally crystallized in two different space groups. The crystal obtained in 0.1 M HEPES buffer (pH 7.5) containing 0.2 M calcium acetate and 20% (w/v) polyethylene glycol 3350, diffracted to 1.65
, purified and finally crystallized in two different space groups. The crystal obtained in 0.1 M HEPES buffer (pH 7.5) containing 0.2 M calcium acetate and 20% (w/v) polyethylene glycol 3350, diffracted to 1.65  resolution and belonged to space group
resolution and belonged to space group  1 with unit-cell parameters of a = 54.3
1 with unit-cell parameters of a = 54.3  , b = 59.3
, b = 59.3  , c = 62.6
, c = 62.6  ,
, 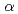 = 69
= 69 ,
, 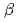 = 81
= 81 ,
, 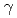 = 80
= 80 . Another crystal obtained in 0.1 M HEPES buffer (pH 7.5) containing 0.2 M sodium chloride and 20% (w/v) polyethylene glycol 3350, diffracted to 1.55
. Another crystal obtained in 0.1 M HEPES buffer (pH 7.5) containing 0.2 M sodium chloride and 20% (w/v) polyethylene glycol 3350, diffracted to 1.55  resolution and belonged to the space group
resolution and belonged to the space group  2
2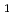 2
2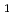 2
2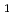 with unit-cell parameters of a = 54.3
with unit-cell parameters of a = 54.3  , b = 110
, b = 110  , c = 130
, c = 130  . These data will enable us to determine the crystal structure of PKS-1.
. These data will enable us to determine the crystal structure of PKS-1.
木下 誉富*; 玉田 太郎; 今井 啓介*; 栗原 和男; 大原 高志; 黒木 良太
Acta Crystallographica Section F, 63(4), p.315 - 317, 2007/04
被引用回数:8 パーセンタイル:65.83(Biochemical Research Methods)ブタ膵臓エラスターゼは、炎症性疾患の原因となる好中球エラスターゼによく似た特徴を有することから、代表的な創薬標的タンパク質の一つである。エラスターゼに共有結合した阻害剤の水素原子を含む構造的な特徴を調べるために、蒸気拡散法により0.2M硫酸ナトリウムを含む重水緩衝液(pD=5.0)中で1.6mm の大きさの単結晶を作製した。この結晶を用いることにより原子力機構のJRR-3に設置されたBIX3中性子回折計で測定を行った結果、空間群P212121,格子長a=51.2
の大きさの単結晶を作製した。この結晶を用いることにより原子力機構のJRR-3に設置されたBIX3中性子回折計で測定を行った結果、空間群P212121,格子長a=51.2 , b=57.8
, b=57.8 , c=75.6
, c=75.6 , 2.3
, 2.3 分解能の中性子回折データの取得に成功した。
分解能の中性子回折データの取得に成功した。
本庄 栄二郎; 玉田 太郎; 前田 宜丈*; 小柴 琢己*; 松倉 康子*; 岡本 智之*; 石橋 松二郎*; 徳永 正雄*; 黒木 良太
Acta Crystallographica Section F, 61(8), p.788 - 790, 2005/08
被引用回数:7 パーセンタイル:54.65(Biochemical Research Methods)顆粒球刺激因子(GCSF)受容体は顆粒球前駆体の分化や増殖を調節する刺激を細胞内へ伝える。その受容体のリガンド結合部位とGCSFの2:2複合体の結晶化を行った。結晶は1.0Mギ酸ナトリウムを含む0.1M酢酸緩衝液(pH4.6)の条件で結晶化した。空間群は 4
4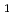 2
2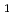 2(もしくは
2(もしくは 4
4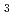 2
2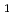 2)で、セル長は
2)で、セル長は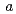 =
=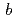 =110.1
=110.1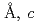 =331.8
=331.8 であった。しかしながら5
であった。しかしながら5 以上の回折データが収集できなかったことから、受容体を陰イオン交換クロマトグラフィーで精製し、再度結晶化を試みた。その結果、3
以上の回折データが収集できなかったことから、受容体を陰イオン交換クロマトグラフィーで精製し、再度結晶化を試みた。その結果、3 以上の回折データが収集可能な新たな晶形の結晶が得られた。その結晶の空間群は
以上の回折データが収集可能な新たな晶形の結晶が得られた。その結晶の空間群は 3
3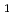 21(or its enantiomorph
21(or its enantiomorph  3
3 21)で、セル長は
21)で、セル長は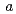 =
=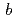 =134.8,
=134.8, 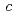 =105.7
=105.7 であった。
であった。